Biotecnologias aplicadas a reprodução de aves
Há um entendimento entre os pesquisadores que o fato da avicultura ser um dos carros-chefes do agronegócio brasileiro está amplamente relacionado ao êxito no desenvolvimento de novas tecnologias que visem o chamado “ajuste fino”, ou seja, deixarmos de estudar as questões no âmbito macro, devido a riqueza de informações que já existem na literatura, para direcionar o foco para os mínimos detalhes, ou seja, com ênfase nas questões minimalistas, sendo estas muitas vezes a nível celular, tecidual, dos órgãos ou sistemas das aves.
Nesse cenário, entender cada processo fisiológico desde a formação do óvulo na galinha até o momento da eclosão do pintinho e suas primeiras horas de vida tornou-se imprescindível para a indústria avícola. O estudo do desenvolvimento embrionário dos pintinhos e as biotecnologias aplicadas são fatores primordiais para a obtenção do sucesso dentro da cadeia produtiva avícola. Estas biotecnologias aplicadas a avicultura visam estudar, melhorar e desenvolver produtos e processos biológicos em associação com a ciência e a tecnologia, com contornos evidentes de multidisciplinaridade, destacando-se ainda que a biotecnologia se encontra relacionada com qualquer aplicação tecnológica que utiliza sistemas biológicos, organismos vivos, ou seres derivados, para fabricar ou modificar produtos ou processos para utilização específica.
Dentre as biotecnologias estudadas e aplicadas pela equipe do Setor de Avicultura da UFAM estão:
INSEMINAÇÃO ARTIFICIAL E MANEJO DE INCUBAÇÃO ARTIFICIAL
Os pioneiros nesta biotecnologia da reprodução avícola são Burrows e Quinn (1937), que desenvolveram o método de massagem abdominal e pressão na região da cloaca, para coletar sêmen de galos. Com a técnica de coletar sêmen de aves, o rápido manuseio e o transporte desse sêmen de um lote de machos para onde se encontram as fêmeas, permitiu flexibilidade para quem trabalha com inseminação artificial e propiciou o desenvolvimento de procedimentos eficientes para preservar o sêmen de aves em condições in vitro por algumas horas (RUTZ et al., 2007).
A inseminação artificial nessas condições é utilizada com sêmen fresco. Esta técnica é utilizada em criações de perus por dificuldades de acasalamento por monta natural e em capotes pela sazonalidade da monta natural. Espermatozóides de aves criopreservados produzem baixa fertilidade de ovos e seu uso ainda é experimental (Gill et al., 1999). A inseminação artificial é aplicada em aves e a coleta de sêmen e seu processamento, foram amplamente revisados por Sexton (1979), Lake (1986) e por Donoghue e Wishart (2000).



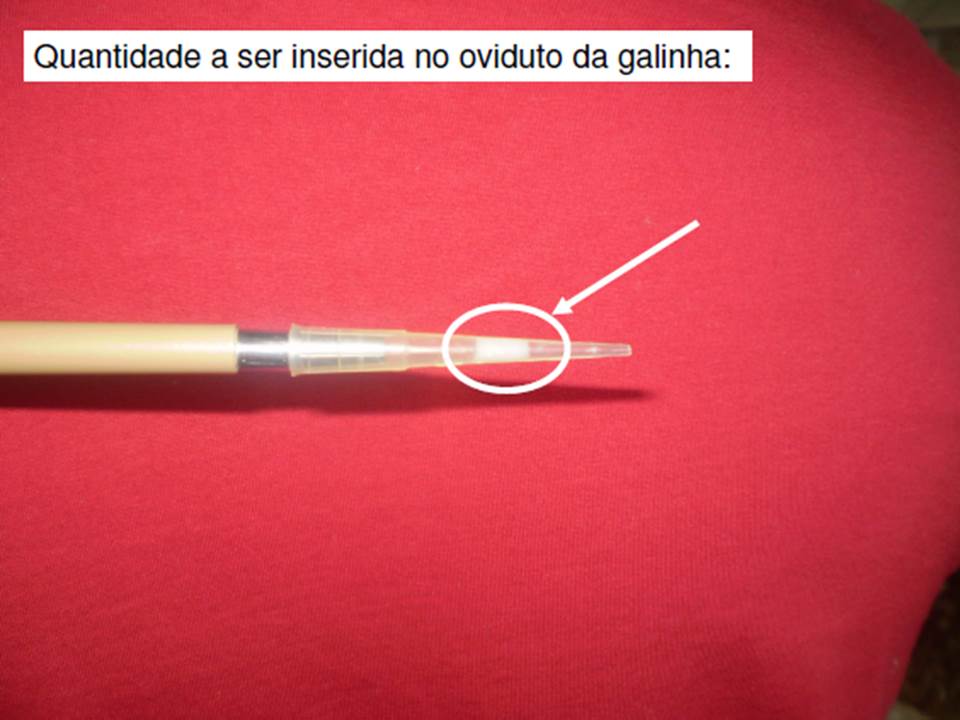

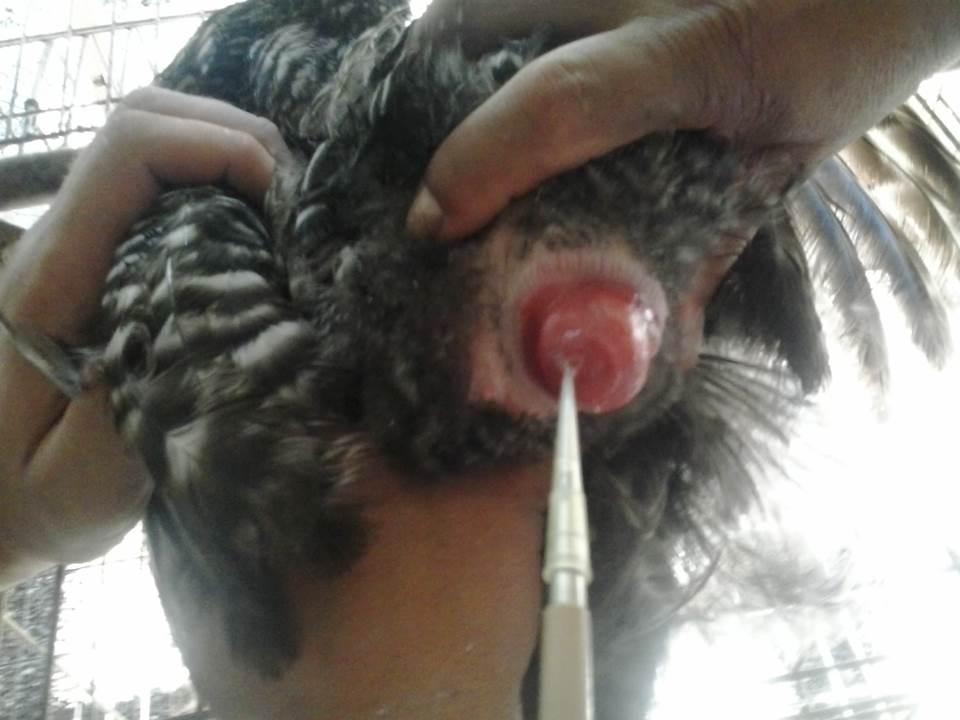
Na inseminação, os galos são submetidos ao processo de coleta de sêmen por meio de massagem abdominal no dorso e movimentos nas laterais da cloaca sendo o sêmen armazenado em pequenos frascos descartáveis tipo eppendorf, para logo em seguida o mesmo procedimento ser aplicado na reversão da cloaca das matrizes e o sêmen ser introduzido no oviduto das fêmeas através da utilização de uma pipeta de volume fixo de 0,025 ml, obedecendo metodologias propostas por Burrows e Quinn (1937); Etches (1996); Bakst e Bahr (1995).

Porém, para que a inseminação apresente resultados positivos deve-se levar em consideração diversos fatores como a escolha do reprodutor e as características seminais do mesmo que podem ser evidenciadas através do exame andrológico (análise de características seminais).


Além disso, deve-se avaliar continuamente os resultados obtidos através da inseminação, incubando os ovos e avaliando o desempenho dos pintos gerados a partir destes.



Algumas vantagens da I.A. em aves:
- Eliminação de acasalamento preferencial;
- Reprodução de linhagens comerciais e espécies de monta difícil ou impossível;
- Menor número de machos pelo mesmo de fêmeas (redução de 7-10% para 2-3%);
- Aumento da descendência dos machos de alto valor genético;
- Elevação nos níveis de fertilidade (é possível compensar quedas na qualidade espermática e na capacidade de armazenamento da fêmea pelo aumento de concentração da dose inseminante e do número de inseminações, além da garantia de que todas as fêmeas foram inseminadas);
- Redução nos custos de alimentação em 10 a 20% (menor necessidade de energia para a atividade sexual);
- Possibilidade de aumentar a capacidade produtiva das instalações já existentes (pode-se dobrar a densidade de criação no galpão ao sair do piso para a gaiola);
- Aumento na porcentagem de ovos incubáveis próximo de 2% (devido ao aumento de ovos limpos).
Desvantagens da I.A. em aves:
- Investimentos iniciais em instalações, equipamentos e treinamento de mão-de-obra;
- Demanda e custo de mão-de-obra especializada;
- Incidência de pododermatite em aves alojadas em gaiolas (especialmente as de linhagens pesadas).
PRESERVAÇÃO DE SÊMEN
O transporte e o manuseio de sêmen de um lote de machos para onde se encontram as fêmeas permitiu uma certa flexibilidade ao pessoal que trabalha com inseminação e propiciou o desenvolvimento de procedimentos eficientes que objetivam preservar o sêmen de aves em condições in vitro por determinados períodos de tempo (RUTZ et al., 2007). Assim, técnicas de preservação do sêmen são importantes para manutenção de maior número de espermatozoides viáveis (SAUVEUR, 1988).
A criopreservação representa ainda um excelente suporte complementar de conservação e pode também ser usada em programas de seleção (HIEMSTRA, 2003; DANCHIN-BURGE & HIEMSTRA, 2003). O único método corrente praticável no manejo de populações de aves é a criopreservação de sêmen, que tem sido estudada especialmente com exemplares da espécie Gallus gallus. Alguns experimentos com sucesso têm sido executados em outras espécies de aves domésticas e silvestres, com grandes diferenças efetivas de acordo com a espécie e condições de criação (MASSIP et al., 2004; BLESBOIS et al., 2005).
É extensiva a lista de diluentes, conservantes, crioprotetores e de protocolos diferentes usados para melhorar o desempenho do sêmen de diversas espécies de aves tentando otimizar a produção de proteína animal para o consumo humano e também otimizar a preservação da diversidade de espécies ainda existentes (MOREIRA-NETO et al., 2009). Nesse contexto, tem-se como características fundamentais para um bom criopreservante que este apresente uma boa composição nutricional, meio com pH estável, presença de indutores da divisão celular e eletrólitos diversos, conferindo-lhe densidade e pH compatíveis com o plasma sanguíneo e fornecendo nutrientes e um ambiente necessários para manter a sobrevivência e a viabilidade dos gametas masculinos e femininos criopreservados (LAVOR & CÂMARA, 2012).


TECNOLOGIAS IN OVO
Para informações sobre esta biotecnologia, clique aqui.
PESQUISA
A partir da testagem e consolidação destas metodologias, a equipe do Setor de Avicultura da UFAM desenvolveu os seguintes trabalhos de pesquisa sobre reprodução avícola:
- Diferentes métodos reprodutivos (monta natural x inseminação artificial) (RUFINO et al., 2014);
- Influência do peso dos galos sobre as características reprodutivas (RUFINO et al., 2015; FEIJÓ et al., 2016);
- Influência dos óleos nas características reprodutivas dos galos (BEZERRA et al., 2015; RUFINO et al., 2018);
- Influência dos períodos de armazenamento de ovos sobre os rendimentos de incubação (NOGUEIRA et al., 2016);
- Influência dos turnos de coleta e períodos de transferência de ovos (MELO et al., 2018);
- Água de coco em pó como preservante do sêmen de galos (FREITAS et al., 2018);
- Extrato de camu-camu (Myrciaria dubia) como diluente de sêmen de galos (SILVA et al., 2024)
- Óleo de coco e óleo de copaíba como diluentes de sêmen de galos (RUFINO et al., 2024)
Referências:
1. BAKST, M. R.; BAHR, J. M. Ciclos reprodutivos: aves domésticas. In: HAFEZ, E. S. E. Reprodução animal. 6.ed. São Paulo: Manole, 1995. p. 390-407.
2. BEZERRA, N.S.; CRUZ, F.G.G.; COSTA, A.P.G.C.; RUFINO, J.P.F.; MELO, R.D.; FEIJO, J.C.; MELO, L.D.; HOLLERVERGER, S.V. S. Óleo de copaíba (Copaifera sp.) na alimentação de galos reprodutores semipesados. Revista Científica de Avicultura e Suinocultura, v. 1, n. 1, p. 1-13, 2015.
3. BLESBOIS, E.; GRASSEAU, I.; SEIGNEURIN, F. Membrane fluidity and the ability to survive cryopreservation in domestic bird spermatozoa. Reproduction, v. 129, p. 371-378, 2005.
4. BURROWS, W. H.; QUINN. J. P. The collection of spermatozoa from the domestic fowl and turkey. Poultry. Science, v. 26, p. 19–24, 1937.
5. DANCHIN-BURGE, C.; HIEMSTRA, S.J. Cryopreservation of domestic animal species in France and Netherlands: Experience, similarities and differences. In: ERFP, ed. Workshop on Cryopreservation of Animal Genetic Resources in Europe, Paris, França, p. 15-28, 2003.
6. DONOGHUE, A. M.; WISHART. G. J. Storage of poultry semen. Animal Reproduction Science, v. 62, p. 213–232, 2000.
7. ETCHES, R.J. Reproduction in poultry. Wallingford, UK: CAB International, 1996.
8. FEIJO, J.C. ; CRUZ, F.G.G.; MELO, R.D.; RUFINO, J.P.F.; DIAS, E.C.S.; BRANDAO, A.B.T. Avaliação reprodutiva e desempenho da progênie na fase inicial de galos semipesados com diferentes pesos corporais. Archives of Veterinary Science, v. 21, n. 1, p. 11-18, 2016.
9. FREITAS, B.K.M.; CRUZ, F.G.G.; RUFINO, J.P.F.; FEIJO, J.C.; MELO, R.D.; MELO, L.D. Powdered coconut water as preservant of semi-heavy cocks semen. Revista Brasileira de Saúde e Produção Animal, v. 19, p. 216-222, 2018.
10. GILL, S. P.; HAMMERSTEDT, R. H.; AMANN. R. P. Poultry artificial insemination: Procedures, current status and future needs. In: Proc. Annu. Mtg. Soc. Theriogenology, Nashville, TN. pp. 353–362, 1999.
11. HIEMSTRA, S.J. (ed.). Guidelines for the Constitution of National Cryopreservation Programmes for Farm Animals. Lelystad/Netherlands: European Regional Focal Point/FAO, 2003. 55p.
12. LAKE, P. E. The history and future of the cryopreservation of avian germ plasm. Poultry Science, v. 65, p. 1 –15, 1986.
13. LAVOR, C.T.B.; CÂMARA, S.R. Biotecnologia do sêmen e inseminação artificial em aves. Ciência Animal Brasileira, v. 22, n. 1, p. 66-81, 2012.
14. MASSIP, A.; LEIBO, S.P; BLESBOIS, E. Cryobiology and the breeding of domestic animals. In: BENSON, E.; FULLER, B.; LANE, N. (ed.). Life in the Frozen State. London: Taylor and Francis Group, p. 371–392, 2004.
15. MELO, L.D.; CRUZ, F.G.G.; RUFINO, J.P.F.; MELO, R.D.; FEIJO, J.C.; COSTA, A.P.G.C. Turnos de coleta e períodos de transferência de ovos de matrizes semipesadas sobre processos de incubação artificial. Archives of Veterinary Science, v. 23, p. 40-48, 2018.
16. MOREIRA-NETO, J.J.S.; GONDIM, J.O.; RADDI, M.S.G.; PANSANI, C.A. Viability of human fibroblasts in coconut water as a storage medium. International Endodontic Journal, v. 42, n. 9, p. 827-830, 2009.
17. NOGUEIRA, M.A.; CRUZ, F.G.G.; RUFINO, J.P.F. ; MELO, R.D. ; FEIJO, J.C. ; BEZERRA, N.S. Períodos de armazenamento de ovos oriundos de duas linhagens semipesadas sobre os rendimentos de incubação e mortalidade embrionária. Revista Científica de Avicultura e Suinocultura, v. 2, n. 2, p. 27-35, 2016.
18. RUFINO, J.P.F.; CRUZ, F.G.G.; MACHADO, N.J.B.; BRASIL, R.J.M.; PEREIRA, P.A.M.; FARIAS, E.G. Processos de incubação artificial associados à aplicação de diferentes métodos reprodutivos em matrizes semipesadas. Revista Brasileira de Saúde e Produção Animal, v. 15, n. 3, p. 765-773, 2014.
19. RUFINO, J.P.F.; CRUZ, F.G.G.; MELO, R.D.; FEIJÓ, J.C.; SILVA, R.O.; BRANDÃO, A.B.T.; BERENCHTEIN, B. Effects of Body weight of semi-heavy cocks on reproductive indices and yields of incubation. International Journal of Poultry Science, v. 14, n. 6, p. 325-330, 2015.
20. RUFINO, J.P.F.; CRUZ, F.G.G.; MELO, R.D.; FEIJÓ, J.C.; MELO, L.D.; COSTA, A.P.G.C.; BEZERRA, N.S. Brazil nut oil in diets for breeder cocks. Acta Scientiarum. Animal Sciences, v. 40, n. 1, p. 1-6, 2018.
21. RUTZ , F.; ANCIUTI, M. A.; XAVIER, E. G.; ROLL, V. F. B.; ROSSI, P. Avanços na fisiologia e desempenho reprodutivo de aves domésticas. Revista Brasileira de Reprodução Animal, v. 31, n. 3, p. 307-317, 2007.
22. SAUVEUR, B. Reproduction femelle formation d’ouef. In: SAUVEUR, B. Reproduction des volailles et production d’oeufs. Paris: INRA,1988. 357p.
23. SEXTON, T. J.; GEE, G. A comparative study on the cryogenic preservation of semen from the sandhill crane and the domestic fowl. Symposium of the Zoological Society of London 43 89–95, 1978.

Redes Sociais